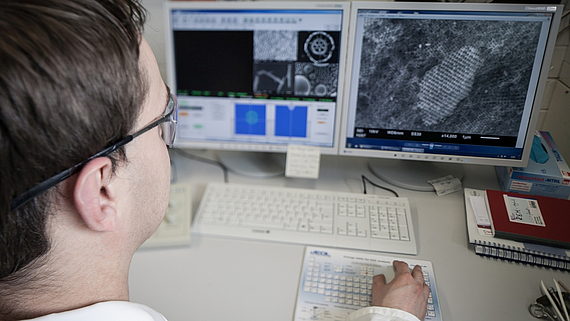
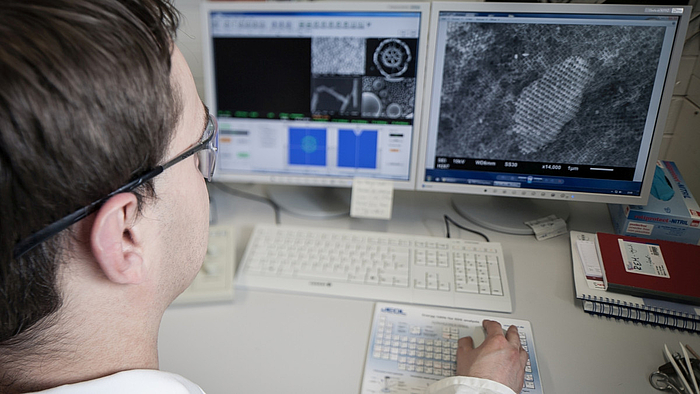
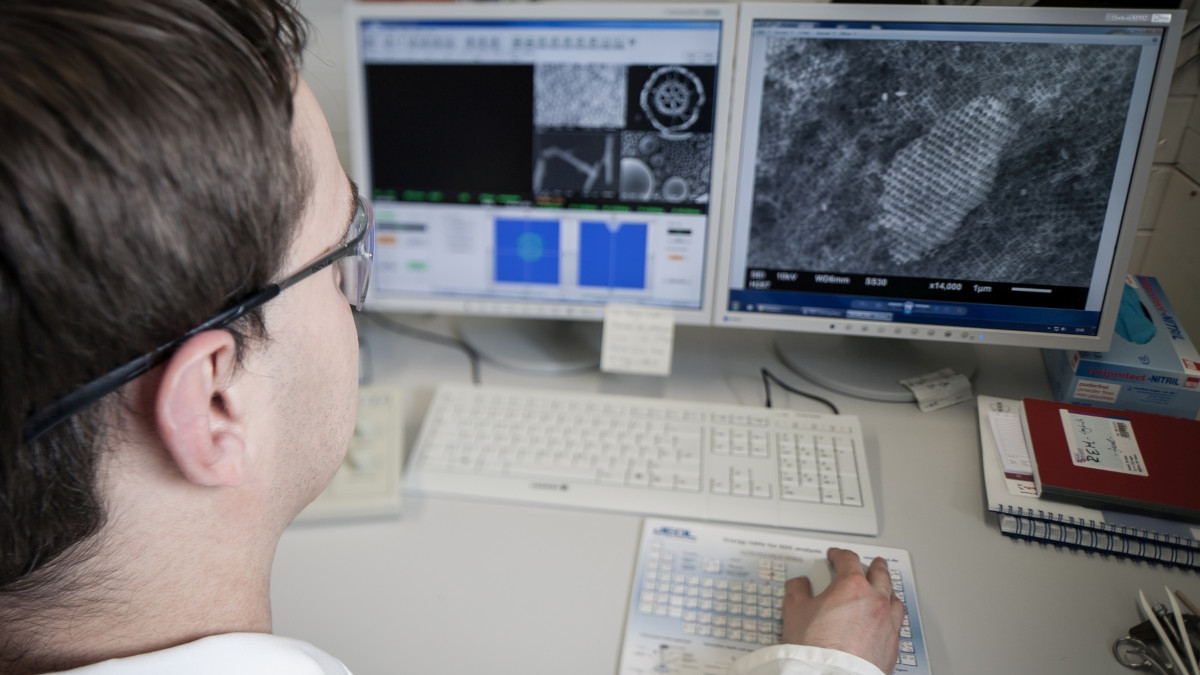
Die Arbeitsgruppe befasst sich unter anderem mit der kontrollierten Synthese Metall-organischer Gerüstverbindungen (metal-organic frameworks, MOFs) unter milden, meist solvothermalen Bedingungen. Mithilfe der Computational Chemistry werden diese anorganisch-organischen Hybridmaterialien zudem modelliert. Ferner interessiert die Funktionalisierung von Festkörperoberflächen. Hieran wird geforscht, um beispielsweise Wirkstoff-freisetzende Beschichtungen für Implantate zu entwickeln.
Biomaterialien und Implantate
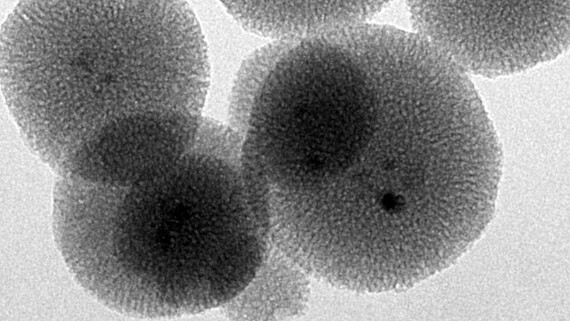
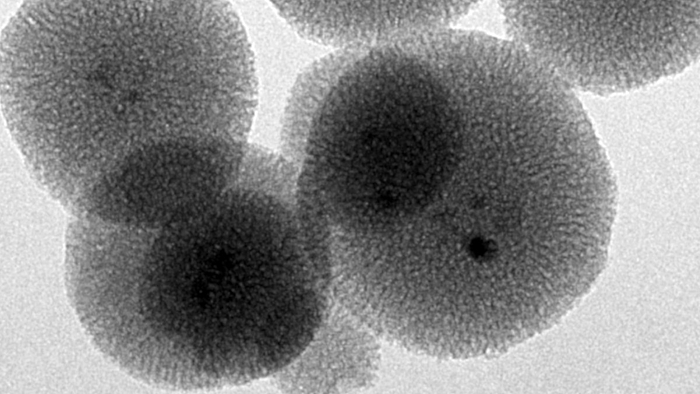
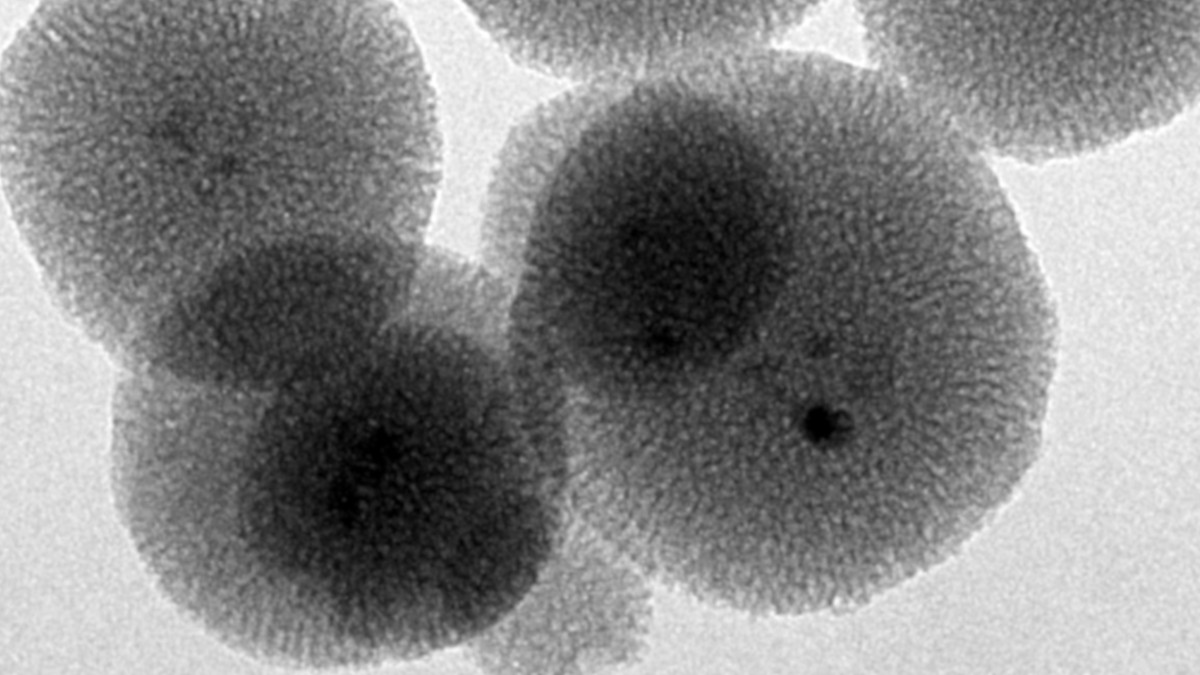
Im Themenfeld Biomaterialien und Implantate wird eine Reihe von Projekten bearbeitet, bei denen oft nanoporöse Materialien eine wichtige Rolle als Reservoir für Medikamentenfreisetzungssysteme spielen. Nanoporöse Medikamentenreservoirs aus anorganischen Materialien bieten den Vorteil, dass ein großes permanentes Volumen (ca. 50% des Gesamtvolumens) zur Speicherung des Wirkstoffs zur Verfügung steht. Dabei installieren wir das Freisetzungssystem im Allgemeinen auf einem Implantat, so dass die Medikamente direkt am gewünschten Wirkort frei gegeben werden (Implantat-assoziiertes Drug Delivery) und Probleme des Targeting umgangen werden. Viele unserer Arbeiten nutzen nanoporöses Silica, aber auch nanoporöse Metalle spielen eine wichtige Rolle, ebenso wie organisch-anorganische Hybridmaterialien wie PMOs (periodic mesoporous organosilicas) oder MOFs (metal-organic frameworks).
Projekte und Forschungsinitiativen
-
Biofabrication for NIFE
In der vom Land Niedersachsen und der Volkswagenstiftung geförderten Forschungsinitiative Biofabrication for NIFE arbeiten wir an der Entwicklung von Freisetzungssystemen, die auf eine Absenkung des pH-Wertes hin Wirkstoffe abgeben, z.B. Antibiotika in Folge der Ansäuerung des Umgebungsmilieus durch eine bakterielle Infektion.
-
Antibakterielle Beschichungen von Oberflächen (ABBO)
Im Rahmen der ZIM-Verbundforschung haben wir gemeinsam mit universitären, außeruniversitären und industriellen Partnern in Form einer nanoporösen Oberflächenbeschichtung Wirkstoffdepots für antibakterielle Medikamente und antiinflammatorisch wirkende Biomoleküle entwickelt.
-
Drug Targeting
Die Anwendung von Nanopartikeln in der Biomedizin scheitert häufig noch am Targeting, also dem Problem, dass die Partikel nicht zum Zielgewebe finden, um dort zu agieren. Im DFG-geförderten Projekt Implantat-gerichtetes magnetisches Drug Targeting führen wir magnetisch ausgerüstete nanoporöse Silica-Nanopartikel über ein durch das magnetisierbare Implantat erzeugtes Magnetfeld zum Zielort.
-
Regeneration
Hearing4all
Über die Freisetzung einfacher Medikamente hinaus befasst sich der Arbeitskreis intensiv mit der Freisetzung komplexerer bioaktiver Moleküle für die Zwecke der Regeneration und der Heilung. Dabei stehen die direkte Beeinflussung zellulären Verhaltens und die kontrollierte Bildung neuer Gewebe im Vordergrund. So arbeiten wir im Exzellenzcluster Hearing4all einerseits daran, die Biologie des Innenohrs korrekt einzustellen und Nervenzellen des Innenohrs zu schützen, um so ihr Überleben zu sichern und eine gute Ansprechbarkeit durch Cochlea-Implantate zu gewährleisten; in diesem Rahmen haben wir z.B. nanoporöse Silica-Nanopartikel entwickelt, die effizient den Wachstumsfaktor BDNF (Brain-Derived Neurotrophic Factor) freisetzen. Ein weiterer Ansatz besteht in der Konstruktion eines neuronal guidance scaffolds, das wachsende Nervenfortsätze zum Implantat leitet. Darüber hinaus beschäftigen wir uns mit der Entwicklung von aktiven ansprechbaren Materialien, die eine erleichterte Implantation ermöglichen sollen.
Gradierte Implantate
Ein anderes Projekt zur Regeneration beschäftigt sich im Rahmen der DFG-Forschungsgruppe Gradierte Implantate mit der Erzeugung von Implantaten, die die Regeneration von Knochen-Sehnen-Übergängen fördern. Hier entwickeln wir nanoporöse Silica-Nanopartikel, die die Wachstumsfaktoren BMP2 (Bone Morphogenetic Protein 2) und TGF-ß3 zeitlich kontrolliert abgeben. Diese werden dann selektiv in bestimmten Regionen einer Fasermatter angebunden. Es spielen also zeitliche als auch räumliche Gradienten eine Rolle. Mit der Freisetzung und Anwendung von BMP2 haben wir uns bereits zuvor im Rahmen des Exzellenzclusters Rebirth beschäftigt. Neben der Freisetzung von small-molecule-Wirkstoffen und Wachstumsfaktoren beschäftigen wir uns im Rahmen der Forschungsinitiative Biofabrication for NIFE auch mit dem delivery von Nukleinsäuren wie z.B. siRNA.
Elektronische und optische Materialien
Im Rahmen des vom Bundesministerium für Wirtschaft und Energie im Förderprogramm finanzierten Projekts ZnMobil arbeiten wir an einer mechanisch und elektrisch wiederaufladbaren Zink-Luft-Batterie für automobile Anwendungen. Unsere Aufgabe in diesem Verbundprojekt mit Partnern aus Industrie, Universitäten und Forschungseinrichtungen ist es, eine „tankbare“ Zinksuspension zu entwickeln, die sich effizient entladen und wieder laden lassen. Als Gegenpart dieser „flüssigen Anode“ steht eine Kathode, an der die Reduktion von Sauerstoff stattfindet. Hierfür haben wir ein sehr leistungsfähiges nanoporöses Kohlenstoffmaterial entwickelt.
Diese Arbeiten haben wir gemeinsam mit der Hochschule Hannover im Rahmen der Hannover School of Nanotechnology „hsn-energy“ durchgeführt.
In mehreren Projekten haben wir uns mit der Entwicklung von transparenten leitfähigen Beschichtungen beschäftigt, unter anderem auf der Basis von Zinkoxid oder Kohlenstoffnanoröhren. Diese sind wichtig für elektrooptische Anwendungen wie LEDs und darauf basierenden Bildschirmen sowie für Solarzellen.
Bei metall-organischen Gerüsten (metal-organic frameworks) interessieren uns neben der Synthese und Präparation bei dieser Substanzklasse vor allen Dingen elektrisch ansprechbare Materialien, die entweder elektrisch leitfähig sind oder deren Eigenschaften sich über elektrische Felder steuern lassen. So untersuchen wir beispielsweise graphen-artige MOFs mit inhärenter Leitfähigkeit und Nanokomposite von MOFs mit Graphen oder Kohlenstoffnanoröhren.
Aktive Materialien



In diesem sehr aktuellen Bereich beschäftigen wir uns mit der Entwicklung von Materialien, die auf einen äußeren Reiz hin ihre mechanischen, optischen oder Leitfähigkeitseigenschaften ändern. Als äußere Reize kommen beispielsweise optische, elektrische oder magnetische Stimulationen in Frage. Solche aktiven Materialien erfordern die genaue Einstellung der Eigenschaften, was sich prinzipiell auf der Basis organischer Polymere verwirklichen lässt. Unser Ansatz konzentriert sich hingegen auf organisch-anorganische Hybridpolymere, die durch die anorganische Komponente eine weitere Möglichkeit zur Einstellung der Eigenschaften bieten. Zu den untersuchten Hybridpolymeren gehören beispielsweise metall-organische Gerüste und Ormocer-artige Materialien. Für solche aktiven Materialien gibt es zahlreiche Anwendungen in unterschiedlichen Gebieten, z.B. in der Implantalogie, die ihre Form während des operativen Einbringungsprozesses ändern, oder bei der Gestaltung optisch aktiver Materialien, die ihren Brechungsindex als Reaktion auf ein angelegtes elektrisches Feld ändern.
Simulation
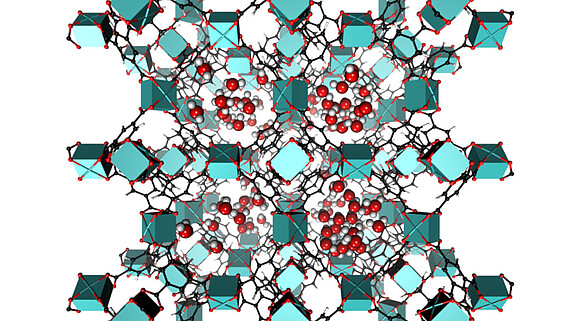
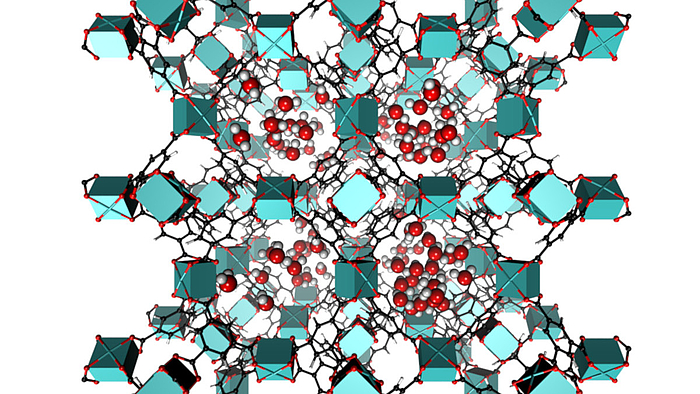
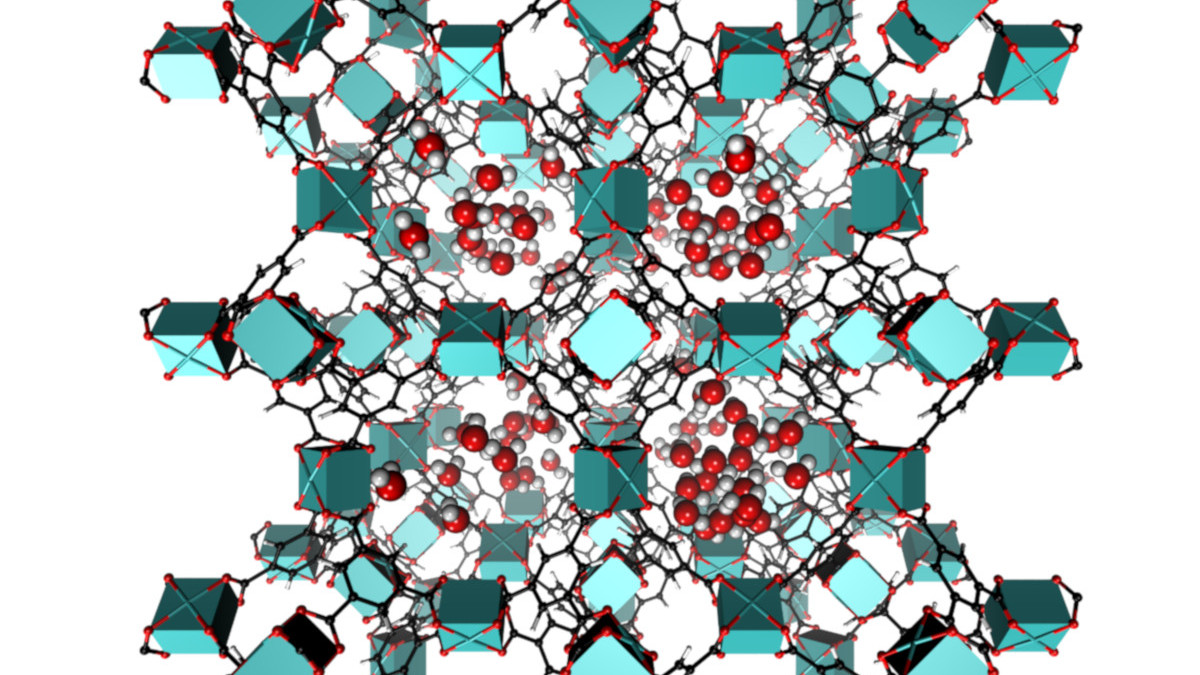
Dieser Themenbereich unterstützt die anderen Bereiche durch die Simulation und Modellierung von Strukturen und relevanten Eigenschaften. Auf Grund der Komplexität der von uns untersuchten Materialien kommen hierfür nur Kraftfeldmethoden oder noch stärker abstrahierende Techniken in Frage.
Im Bereich der metall-organischen Gerüstverbindungen (MOFs) nutzen wir die Kraftfeldmodellierungen einerseits zur Untersuchung genereller Eigenschaften, wie z.B. den Sorptionscharakteristika der nanoporösen Gerüste. In einem spezialisierterem Projekt bereiten wir Methoden vor, die dazu dienen sollen, Koordinationskäfige aufzubauen, die höchstspezifische Erkennungseigenschaften aufweisen. Diese sollen dazu dienen, hochgradig spezifische Sensoren zu konstruieren. Diese Arbeiten führen wir im Rahmen der Hannover School of Nanotechnology hsn-sensors durchgeführt, einem am LNQE lokalisierten Promotionsprogramm des Landes Niedersachsen.
So haben wir erstmals valide Modellierungsstudien an Ormocer®en durchgeführt, einer interessanten, aber strukturchemisch höchst komplex aufgebauten Materialklasse. Diese Arbeiten wurden im Rahmen des Promotionsprogramms MARIO (gefördert durch das Land Niedersachsen) gefördert. Da sich gezeigt hat, dass für solche Materialien und ähnlich komplex aufgebaute Nanokomposite aus Polymeren und Nanopartikeln Kraftfeldmethoden oft nicht mehr zum Ziel führen, arbeiten wir derzeit an der Entwicklung von coarse-grain-Modellen.










